Associação entre bactérias e Candida sp. no desenvolvimento de mucosite oral em pacientes em tratamento quimioterápico diagnosticados com doenças onco-hematológicas
Association between bacteria and Candida sp. in the development of oral mucositis in patients under chemotherapeutic treatment diagnosed with onco-hematological diseases
Jordana Salvagni1, Renan Amorin1, Alice Tormena1, Geórgia Muccillo-Dexheimer2
1 Universidade do Vale do Taquari – Univates, Graduação em Biomedicina. Lajeado, RS, Brasil.
2 Universidade do Vale do Taquari – Univates, Doutorado em Biotecnologia, Professora da Universidade do Vale do Taquari. Lajeado, RS, Brasil.
Recebido em 22/09/2022
Aprovado em 22/12/2022
DOI: 10.21877/2448-3877.202200073
INTRODUÇÃO
As doenças onco-hematológicas, também denominadas neoplasias hematológicas, são um grupo de doenças malignas que afetam as células hematopoiéticas, geralmente causando prejuízo ao sistema imunológico. O desenvolvimento das neoplasias hematológicas está associado a vários fatores (físicos, químicos e ambientais), que podem causar alterações que levam à proliferação e diferenciação de células anormais.(1) Entre as neoplasias hematológicas mais comuns estão as leucemias, os linfomas e o mieloma múltiplo. São, de forma geral, doenças com evolução lenta e progressiva, com período assintomático, e podem passar despercebidas entre outras patologias preexistentes.(2)
Os linfomas compreendem um grupo de neoplasias que afetam tecidos linfoides e possuem um padrão variado de comportamento clínico, como tipo histológico, fatores clínicos e características moleculares.(3) São divididos em dois grandes grupos: linfomas não-Hodgkin e linfoma de Hodgkin.(1) A leucemia é caracterizada por distúrbios que apresentam aumento do número de leucócitos no sangue ou na medula óssea.(4) Os quatro tipos primários de leucemias são a leucemia mieloide aguda (LMA), a leucemia mieloide crônica (LMC), a leucemia linfoide aguda (LLA) e a leucemia linfoide crônica (LLC), porém existem mais de 12 tipos dessa neoplasia.(5) O mieloma múltiplo (MM) é uma doença caracterizada pelo crescimento descontrolado das células plasmáticas monoclonais na medula óssea, causando a superprodução de produtos não funcionais, como imunoglobulinas.(6)
A quimioterapia é um dos tratamentos existentes e consiste na administração de agentes químicos com potencial antitumoral. Sua principal função é destruir células malignas, impedindo seu crescimento e multiplicação.(7) Os agentes antineoplásicos agem de forma sistêmica no organismo atingindo células que estão em processo de divisão, podendo afetar tanto células malignas quanto normais, porém as células malignas são as mais atingidas em razão da aumentada quantidade de processos metabólicos.(8)
Os efeitos colaterais resultantes da quimioterapia antineoplásica como tratamento de pacientes onco-hematológicos são classificados de acordo com a intensidade e duração dos sintomas. Os pacientes podem apresentar efeitos colaterais mais graves, mais leves, ou não apresentar qualquer adversidade no decorrer do tratamento. O tratamento pode comprometer o sistema gastrointestinal, causar anemia, reações alérgicas, náusea, neutropenia, alopecia, problemas pulmonares, vômitos, anafilaxia, entre outros problemas no decorrer do tratamento quimioterápico.(9)
A mucosite é um dos principais efeitos colaterais limitantes da quimioterapia, e pode afetar a ingestão nutricional, a função oral e até mesmo intestinal. Os sintomas podem aparecer de 5 a 10 dias após a aplicação do tratamento e evoluir para quadros mais graves.(10) Lesões na mucosa oral podem servir como porta de entrada para infecções, principalmente em pacientes imunossuprimidos pelo tratamento quimioterápico, e evoluir para quadros de infecção sistêmica.(11) Assim como a mucosite, a neutropenia é uma complicação comum em pacientes quimioterápicos, que pode variar desde febre a infecções generalizadas e sepse.(12) A neutropenia é caracterizada pela diminuição de células brancas do sangue, com contagem de neutrófilos abaixo de 1,5×109/L. Pacientes que apresentam neutropenia induzida por quimioterapia têm risco de infecções potencialmente fatais. A neutropenia é um grande interferente durante a realização dos ciclos quimioterápicos,(13) pois gera debilidade imunológica nos pacientes.
Diante do exposto é possível observar a importância da microbiota oral e a sua influência sobre o grau de acometimento causado pela mucosite oral e como a capacidade de reação do sistema imune é fundamental para o prognóstico do paciente. O estudo teve como propósito verificar a frequência de infecções oportunistas em pacientes onco-hematológicos no período de janeiro de 2019 a dezembro de 2020 em um hospital de referência no sul do Brasil e avaliar a composição da microbiota endógena oral relacionando os microrganismos encontrados com potenciais agentes patogênicos de infecções bucais na mucosite oral.
MATERIAL E MÉTODOS
Local e população de estudo
Os pacientes incluídos neste estudo, tanto para a análise retrospectiva quanto para análise da composição da microbiota endógena oral, foram diagnosticados com doença onco-hematológica e iniciaram tratamento quimioterápico. Estes pacientes estavam em atendimento no hospital de médio porte no interior do Rio Grande do Sul, referência no serviço onco-hematológico da região.
Avaliação da frequência de infecções oportunistas
Primeiramente, a população atendida no local de estudo foi avaliada de forma retrospectiva através da análise de prontuários e evoluções médicas. O período analisado foi de janeiro de 2019 a dezembro de 2020. Assim, todos os pacientes diagnosticados com doenças onco-hematológicas e que iniciaram tratamento quimioterápico foram avaliados quanto à manifestação de infecções oportunistas, eventos adversos associados à mucosa oral e trato gastrointestinal, relacionados à baixa imunidade durante o tratamento. Foram excluídos apenas pacientes com prontuários incompletos, com comorbidades como doenças imunossupressoras ou doenças autoimunes.
Os dados coletados foram: idade, sexo, tipo de doença onco-hematológica diagnosticada, tratamento realizado, dados do exame hematológico realizado após o primeiro ciclo de quimioterapia (número global de leucócitos, neutrófilos segmentados, bastonetes), temperatura da febre, diarreia, vômito, mucosite oral, sepse e óbito. As doenças foram classificadas de acordo com a classificação da Organização Mundial da Saúde (OMS) e os eventos adversos foram classificados em graus de acordo com o CTCAE 5.0.
Avaliação da composição da microbiota endógena oral
Após análise de frequência de infecções oportunistas de forma retroativa, foram realizadas coletas para avaliação da mucosa oral de pacientes onco-hematológicos em tratamento quimioterápico, por meio da coleta e cultura microbiológica de swabs bucais.
Foram selecionados pacientes onco-hematológicos, com mais de 18 anos, que estavam realizando tratamento quimioterápico no momento da coleta e que não possuíam outras doenças imunológicas. As coletas foram realizadas durante o período de janeiro e fevereiro de 2021, no serviço de oncologia do hospital, e as amostras foram encaminhadas para o Laboratório de Microbiologia da Universidade do Vale do Taquari – Univates.
Coleta de swab oral e análise laboratorial
As coletas foram realizadas com um swab estéril e semeadas nos meios de crescimento ágar chocolate, ágar MacConkey e ágar sangue (LABORCLIN) e permaneceram na estufa a 37°C por 24 horas para crescimentos bacterianos e em ágar Sabouraud dextrose com cloranfenicol (NEOGEN) e incubadas em estufa a 25ºC, durante 3 dias, para que ocorresse o crescimento fúngico.
As amostras bacterianas foram isoladas em ágar Mueller-Hinton (LABORCLIN) e identificadas através de provas bioquímicas. Após a identificação, foi realizado o antibiograma das amostras, através da técnica de disco-difusão, para a verificação da sensibilidade e resistência aos principais fármacos utilizados, seguindo o protocolo estipulado pelo Clinical & Laboratory Standards Institute (CLSI).
As amostras fúngicas crescidas no ágar Sabouraud dextrose com cloranfenicol foram semeadas em CHROMagar Candida® (LABORCLIN). A identificação foi realizada conforme as instruções do fabricante. As colônias que apresentaram coloração azul foram classificadas como Candida tropicalis, rosa-pálido como Candida krusei, e as que apresentaram colônias verdes foram avaliadas como Candida albicans. Após o crescimento fúngico, foi realizado o teste do tubo germinativo, para a identificação da espécie Candida albicans. O antifungigrama foi realizado através da técnica de disco-difusão, em que foi analisada a suscetibilidade das amostras de Candida sp. que foram identificadas frente aos antifúngicos.
ÉTICA
O presente estudo contou com a aprovação do Comitê de Ética em Pesquisa sob parecer número 4.385.689. Os participantes foram instruídos sobre a pesquisa e assinaram o Termo de Consentimento Livre e Esclarecido e os autores asseguram a confidencialidade dos dados através do Termo de Compromisso de Uso de Dados.
RESULTADOS
Para a análise retrospectiva foram avaliados prontuários dos anos de 2019 e 2020, e 69 pacientes com doenças onco-hematológicas e deram início ao tratamento quimioterápico no hospital do estudo foram incluídos na pesquisa. Os tipos de leucemias mais prevalentes foram leucemia mieloide aguda e leucemia/linfoma de células B (Tabela 1).
Dos 69 pacientes analisados, 37 (53,6%) foram a óbito, sendo que, destes, 3 (4,3%) tiveram como causa o choque séptico e 6 (8,6%) a neutropenia febril. Salienta-se que 2 dos 3 pacientes que evoluíram para choque séptico também apresentavam neutropenia febril. Dentre os eventos adversos, como diarreia, vômito, febre, neutropenia febril, leucopenia, neutropenia, mucosite e sepse, foram identificados um total de 123 eventos (Tabela 2).
A análise da microbiota endógena oral teve a participação de 29 pacientes, e as amostras coletadas foram semeadas nos respectivos meios para crescimento e identificação. No decorrer do estudo, 3 amostras para análise bacteriana foram excluídas passando, assim, a serem 26 amostras analisadas.
Dos 26 participantes, 10 (38,46%) eram mulheres e 16 (61,54%) eram homens com idades entre 25 e 83 anos, tendo a maioria mais de 50 anos (65,38%) (Tabela 3).
Todos os participantes possuíam alguma neoplasia hematológica e faziam uso de terapia medicamentosa ou de esquemas terapêuticos com finalidade curativa ou paliativa durante o período das coletas (Tabela 4).
Após o período de incubação, 13 (50%) amostras tiveram crescimentos bacterianos. Para este estudo, qualquer crescimento na placa foi considerado, não sendo observada a quantidade de colônia. As amostras foram identificadas como Staphylococcus aureus (46,1%), Enterococcus sp. (46,1%) e Streptococcus sp. (7,8%).
O teste de sensibilidade a antibióticos foi realizado pelo método de disco-difusão em ágar Mueller-Hinton e permaneceu na estufa a 35ºC por 24 horas antes da realização da leitura. Os antibióticos foram usados de acordo com a bactéria identificada. As amostras se mostraram sensíveis à maioria dos antibióticos utilizados (Tabelas 5, 6 e 7), não mostrando nenhuma resistência significativa.
Todos os 29 participantes foram incluídos na pesquisa de Candida sp., sendo 19 (65,5%) do sexo masculino e 10 (34,5%) do sexo feminino A idade média dos indivíduos foi de 58 anos ± 16,07, variando de 23 a 83 anos, sendo que a maioria dos participantes do estudo (46,67%) possuía entre 61 a 85 anos (Figura 1).
Dos 29 (n =29) indivíduos avaliados neste estudo, todos possuíam alguma doença onco-hematológica (Tabela 8) e estavam seguindo orientações medicamentosas e o uso de alternativas terapêuticas de tratamento paliativo ou curativo.
No presente estudo, observou-se crescimento em 06 (20,68%) destas amostras, as quais apresentaram colônias com aspectos brilhantes ou opacos, coloração branca a creme, textura cremosa, bordas regulares ou irregulares e odor de levedo positivo para Candida sp. Os pacientes com crescimento positivo estavam fazendo uso de terapias medicamentosas com os antineoplásicos: Hidroxiureia, R-CHOP, Citarabina+Daunorrubicina e Cybord.
Todas as amostras clínicas com crescimento [06 (20,68%)] apresentaram a formação de brotamento.
Observou-se a presença de colônias com a coloração verde-claro a verde médio, indicadas como Candida albicans em todas as 06 (20,68%) que apresentaram crescimento.
Dentre os antifúngicos utilizados para identificação da resistência antifúngica destacam-se triazólicos, como fluconazol e itraconazol, e derivados poliênicos, como anfotericina B. Foi observado que 100% (06) das amostras foram sensíveis à anfotericina B, 83,30% (05) foram resistentes ao fluconazol e 66,70% (04) foram resistentes ao itraconazol (Tabela 9).
Tabela 1
Perfil dos pacientes adicionados ao estudo
| Variável | N | % |
| Total | 69 | 100 |
| Homens | 35 | 50,7 |
| Mulheres | 34 | 49,2 |
| Idade | 54,4 | 17,1* |
| Tabagista | 11 | 15,9 |
| Etilista | 7 | 10,1 |
| Síndrome mieloproliferativa | 3 | 4,3 |
| Síndrome mielodisplásica | 4 | 5,7 |
| Leucemia mieloide aguda | 29 | 42,02 |
| Leucemia/linfoma de células B | 25 | 36,2 |
| Leucemia/linfoma de células T | 8 | 11,59 |
*Desvio padrão
Fonte: Dos autores (2022).
Tabela 2
Frequência de efeitos adversos
| Evento Adverso | Grau | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Diarreia | 6 (4,8%) | – | – | – | – |
| Vômito | 9 (7,3%) | 1 (0,81%) | – | – | – |
| Febre | 33 (26,82%) | 1 (0,81%) | – | 1 (0,81%) | – |
| Neutropenia febril | – | – | – | 5 (4,06%) | 8 (6,5%) |
| Leucopenia | 13 (10,5%) | 3 (2,43%) | 6 (4,87%) | 6 (4,87%) | – |
| Neutropenia | – | 5 (4,06%) | 2 (1,62%) | 14 (11,38%) | – |
| Mucosite | – | 5 (4,06%) | – | – | – |
| Sepse | – | – | 1 (0,81%) | 1 (0,81%) | 3 (2,43%) |
Fonte: Dos autores (2022).
Tabela 3
Idade e sexo dos participantes
| Sexo | N | % |
| Mulheres | 10 | 38,46 |
| Homens | 16 | 61,54 |
| Total | 26 | 100 |
| Idade | N | % |
| 18 – 30 | 3 | 11,54 |
| 31 – 40 | 3 | 11,54 |
| 41 – 50 | 3 | 11,54 |
| 51 – 60 | 4 | 15,37 |
| 61 – 70 | 8 | 30,78 |
| < 70 | 5 | 19,23 |
| Total | 26 | 100 |
Fonte: Dos autores (2021).
Tabela 4
Tipos de neoplasias e tratamento em uso
| Tipo de neoplasia | N | % |
| LMC – Leucemia mieloide crônica | 8 | 30,77 |
| LMA – Leucemia mieloide aguda | 3 | 11,54 |
| LLA – Leucemia linfoide aguda | 2 | 7,69 |
| LLC – Leucemia linfoide crônica | 6 | 23,08 |
| MM – Mieloma múltiplo | 7 | 26,92 |
| Total | 26 | 100 |
| Medicamento | N | % |
| R-CHOP | 5 | 19,23 |
| CYBORD | 3 | 11,54 |
| CDTD | 3 | 11,54 |
| Imatinib 400mg | 4 | 15,37 |
| Desatinibe 100mg | 1 | 3,85 |
| Hidroxiureia | 3 | 11,54 |
| ARAC 7 +3 | 2 | 7,69 |
| AINDA | 1 | 3,85 |
| Hiper-CVAD | 2 | 7,69 |
| Tal + Dexa | 1 | 3,85 |
| CVP | 1 | 3,85 |
| Total | 26 | 100 |
Fonte: Dos autores (2021).
Tabela 5
Sensibilidade da amostra de Enterococcus sp. aos principais antibióticos utilizados no tratamento de infecções causadas por este agente.
| Amostra
Nº |
Ampicilina
(mm) |
Imipeném
(mm) |
Ciprofloxacino
(mm) |
Linezolida
(mm) |
Vancomicina
(mm) |
| 21 | 45 (S) | 32 (I) | 30 (S) | 24 (S) | 0 (R) |
Halo dos antibióticos em milímetros (mm). Ampicilina S <10mm, I 8-9mm; R >8mm, Imipeném S <50mm, I 21-49mm, R >21mm; Ciprofloxacino S <15mm, R >15mm; Linezolida S <20mm, R <20mm; Vancomicina S <12mm, R >12mm
S: Sensível I: Intermediário R: Resistente.
Fonte: Dos autores (2021).
Tabela 6
Sensibilidade das amostras de Staphylococcus aureus aos principais antibióticos utilizados no tratamento de infecções causadas por este agente.
| Amostra | Cefotaxima
(mm)
|
Gentamicina (mm)
|
Eritromicina (mm)
|
Cloranfenicol (mm)
|
Sulfametoxazol + trimetoprim
(mm) |
Rifampicina
(mm)
|
Clindamicina
(mm)
|
Ciprofloxacino
(mm)
|
| 20 | 26 (S) | 28(S) | 29 (S) | 26 (S) | 0 (R) | 28 (S) | 34 (S) | 40 (I) |
| 16 | 32 (S) | 26 (S) | 28(S) | 10 (R) | 18 (S) | 30 (S) | 32(S) | 36 (I) |
| 1 | 49 (S) | 30 (S) | 34 (S) | 32 (S) | 0 (R) | 30 (S) | 28 (S) | 46 (I) |
| 19 | 42 (S) | 29 (S) | 32 (S) | 30 (S) | 0 (R) | 30 (S) | 18 (R) | 42 (I) |
| 2 | 32 (S) | 18 (S) | 0 (R) | 34 (S) | 0 (R) | 28 (S) | 23 (S) | 0 (R) |
| 17 | 32 (S) | 26 (S) | 28 (S) | 28 (S) | 0 (R) | 30 (S) | 26 (S) | 35 (I) |
Halo dos antibióticos em milímetros (mm). Cefotaxima S>22mm, R<22mm; Gentamicina S >18mm, R<18mm; Eritromicina S>21mm, I 18-20mm, R<18mm; Cloranfenicol S>18mm, R<18mm; Sulfametoxazol + trimetoprim S>17mm, I 14-16mm, R <14mm; Rifampicina S>22mm, I 23-25mm, R<23mm; Clindamicina S>22mm, I 19-21mm, R<19mm.
S: Sensível I: Intermediário R: Resistente.
Fonte: Dos autores (2021).
Tabela 7
Sensibilidade das amostras de Streptococcus sp. aos principais antibióticos utilizados no tratamento de infecções causadas por este agente.
| Amostra | Sulfametoxazol + trimetoprim
(mm) |
Benzilpenicilina (mm) | Linezolida (mm) | Levofloxacino (mm) | Eritromicina (mm) | Clindamicina (mm) | Clindamicina (mm) | Tigeciclina (mm) | Cloranfenicol
(mm) |
| 22 | 26 (S) | 32 (S) | 36 (S) | 30 (I) | 28 (S) | 44 (S) | 34 (S) | 20 (S) | 40 (S) |
| 6 | 0 (R) | 32 (S) | 40 (S) | 22 (I) | 20 (R) | 46 (S) | 30 (S) | 29 (S) | 44 (S) |
| 13 | 0 (R) | 38 (S) | 36 (S) | 30 (I) | 32 (S) | 50 (S) | 0 (R) | 26 (S) | 38 (S) |
| 10 | 24(S) | 34 (S) | 30 (S) | 34 (I) | 27(S) | 45 (S) | 32(S) | 29(S) | 42 (S) |
| 12 | 28 (S) | 36 (S) | 39 (S) | 25 (I) | 32 (S) | 51 (S) | 28 (S) | 33 (S) | 39 (S) |
| 5 | 0 (R) | 30 (S) | 42 (S) | 32 (I) | 30 (S) | 47 (S) | 12(R) | 22 (S) | 28 (S) |
Halo dos antibióticos em milímetros (mm). Sulfametoxazol + trimetoprim S >18mm, I 15-17mm, R <15mm; Benzilpenicilina S <18mm, R >18mm; Linezolida S >20mm, R <20mm; Levofloxacino S >50mm, I 17-49mm, R<17mm; Eritromicina S >21 mm, I 18-20mm, R <18mm; Eritromicina S >21 mm, I 18-20mm, R <18mm; Clindamicina S >17mm, R <17mm; Clindamicina S >17mm, R <17mm; Tigeciclina S >19mm, R <19mm; Cloranfenicol S <19mm, R >19mm.
S: Sensível I: Intermediário R: Resistente
Fonte: Dos autores (2021).
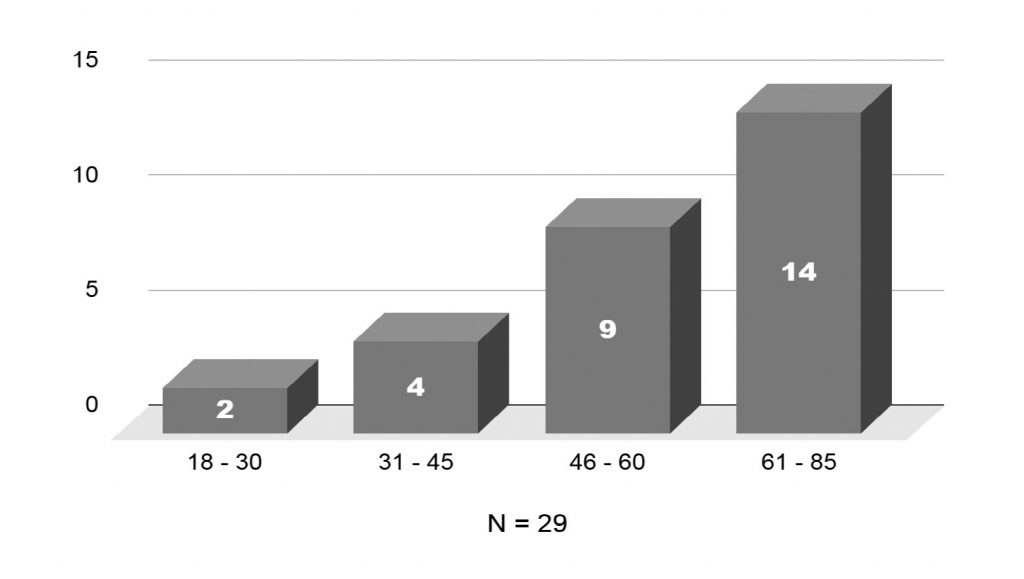
Figura 1
Distribuição total dos pacientes participantes da pesquisa quanto à idade.
Fonte: Dos autores (2021).
Tabela 8
Frequência dos tipos de doenças onco-hematológicas.
| Doenças onco-hematológicas | N | % |
| LLA – Leucemia linfoide aguda | 2 | 06,90% |
| LLC – Leucemia linfoide crônica | 6 | 20,68% |
| LMA – Leucemia mieloide aguda | 3 | 10,34% |
| LMC – Leucemia mieloide crônica | 11 | 37,94% |
| Mieloma múltiplo | 7 | 24,14% |
| Total | 29 | 100% |
Fonte: Dos autores (2021).
Tabela 9
Sensibilidade de cepas de C. albicans [06 (20,68%)] (n=29) aos antifúngicos de acordo com os halos.
| Antifúngicos | |||||||||
| Anfotericina B (100µg) | Fluconazol (25µg) | Itraconazol (10µg) | |||||||
| S | I | R | S | I | R | S | I | R | |
| ≥10mm | ≤10mm | ≤10mm | ≥19mm | 18 a 15mm | ≤14mm | ≥20mm | 19 a 12mm | ≤11mm | |
| 22 | – | – | – | – | SH | 26 | – | – | |
| 22 | – | – | 22 | – | – | 24 | – | – | |
| 20 | – | – | – | – | SH | – | – | SH | |
| 20 | – | – | – | – | SH | – | – | SH | |
| 28 | – | – | – | – | SH | – | – | SH | |
| 22 | – | – | – | – | SH | – | – | SH | |
ID: Identificação, S: Sensível, I: Intermediário, R: Resistente, SH: Sem Halo.
Fonte: Dos autores (2021).
DISCUSSÃO
A cavidade oral apresenta grande diversidade de microrganismos. A microbiota bucal encontra-se normalmente em harmonia com o hospedeiro, porém as lesões desencadeadas pelo processo inflamatório gerado pela mucosite podem resultar no acometimento da mucosa oral, propiciando a entrada de microrganismos da microbiota bucal, que passam a desencadear quadros infecciosos. A sintomatologia da mucosite oral traz graves consequências para a qualidade de vida dos pacientes. Os principais sinais e sintomas são ulcerações da mucosa com dor intensa, dificuldade de alimentação, dificuldade para falar e fazer a higiene oral e presença de infecções oportunistas.(14)
Os microrganismos oportunistas colonizadores da mucosa oral podem representar um perigo eminente para os pacientes oncológicos. O paciente submetido à quimioterapia antineoplásica desenvolve leucopenia significativa, tornando-se extremamente suscetível ao desenvolvimento de infecções oportunistas, devido ao imunocomprometimento gerado pelo tratamento.(15) Os medicamentos quimioterápicos atuam em todas as células sem diferenciação, evitando a proliferação das células alteradas, porém afetando também células saudáveis, o que pode ocasionar lesão na mucosa oral (tecido com células de rápida renovação). Um tipo de lesão gerada é a mucosite, que está altamente relacionada ao surgimento de infecções por patógenos oportunistas.(16)
Os eventos adversos mais encontrados na amostra de estudo foram febre (28,44%), seguida de leucopenia (22,67%), neutropenia (17,06%), neutropenia febril (40,56%), vômito (8,11%), diarreia (4,8%), mucosite (4,05%) e sepse (4,05%). Andrade e Silva(9) relatam que a toxicidade dos fármacos antineoplásicos pode atingir, com mais frequência, o sistema hematológico, causando leucopenia, neutropenia e anemia, o sistema gastrointestinal, causando vômitos, diarreias e mucosite, além de, de forma menos incidente, alterações hepáticas, neurológicas e dermatológicas.
Um dos microrganismos encontrados na pesquisa foi a bactéria do gênero Streptococcus sp. com características beta-hemolíticas. Os Streptococcus spp. formam o maior grupo de bactérias existentes na mucosa oral e são responsáveis por várias patologias, como cárie dentária, infecções orais e infecções noutros órgãos e sistemas.(17) Diversos autores citam o microrganismo como agente causador de infecções associadas à mucosite. Sobue et al. (2018)(18) correlacionam a presença abundante de Streptococcus com o desenvolvimento de mucosite mais grave. Os Streptococcus do grupo viridans estão frequentemente associados a septicemia em pacientes oncológicos que realizam quimioterapia.(18,19) Osakabe et al. (2017)(20) afirmam que as espécies de Streptococcus são bastante frequentes na mucosa oral, assim como Andrioni (2019) (21) e Ames et al. (2012).(22)
Os Streptococcus identificados neste estudo mostraram grande sensibilidade aos fármacos utilizados. A maior taxa de resistência observada nas amostras foi em relação ao sulfametoxazol+trimetoprim. A resistência ao sulfametoxazol e ao trimetoprim apresenta relação direta com o uso indiscriminado dos antimicrobianos, selecionando agentes que não sejam mais suscetíveis ao fármaco.(23) As demais foram resistências pontuais a algum antibiótico.
Outro microrganismo encontrado nas amostras do estudo foi o Staphylococcus aureus, um patógeno oportunista encontrado na microbiota das mucosas e na pele humana, capaz de causar infecções graves ao penetrar no organismo humano. O isolamento e a prevalência de cepas multirresistentes a antibióticos têm sido demonstrados em hospitais, tornando o tratamento mais difícil.(24) No antibiograma, as amostras identificadas como Staphylococcus aureus também se mostraram amplamente resistentes aos antibióticos sulfametoxazol+trimetropim, assim como Streptococcus sp. Demais resistências foram visualizadas, porém ocorreram de forma isolada entre as amostras.
O último microrganismo identificado nas amostras do estudo foi o Enterococcus sp. Os Enterococcus spp. compõem a microbiota intestinal de seres humanos e de animais saudáveis. Estão amplamente distribuídos no ambiente e frequentemente implicados em infecções em animais e humanos imunocomprometidos.(25) Gaetti-Jardim Júnior et al. (2014)(26) citam esse microrganismo como um oportunista que pode colonizar a mucosa oral. É associado a infecções e quadros septicêmicos. No entanto, não é citado com frequência em estudos sobre a mucosite oral.
A amostra identificada como Enterococcus sp. mostrou sensibilidade à maioria dos antimicrobianos utilizados, exceto à vancomicina. O gênero Enterococcus apresenta resistência intrínseca a vários antimicrobianos e progressiva resistência adquirida. A resistência à vancomicina ocorre basicamente pela produção de precursores de peptideoglicano na parede celular que se ligam pobremente à vancomicina, impedindo assim sua ação no bloqueio da síntese de parede celular. Espécies como E. casseliflavus e E. gallinarum são conhecidas por apresentarem resistência intrínseca à vancomicina.(27)
Candida sp. é um fungo oportunista comum da cavidade bucal de pacientes onco-hematológicos que estão em tratamento quimioterápico. O patógeno mais comum é Candida albicans que vive de modo comensal por um processo complexo envolvendo fatores relacionados às células de levedura, células hospedeiras e fatores ambientais que contribuem para a virulência do organismo.(28)
Segundo Silva et. al (2016),(29) a candidíase oral, causada por espécies de Candida sp., afeta diretamente a qualidade de vida dos pacientes e pode causar complicações sistêmicas, aumentando o risco de morbidade e mortalidade e os custos do tratamento. De acordo com Sousa et al. (2020),(30) a Candida sp. é um fungo de alta incidência e importância clínica com o aumento do número de indivíduos imunocomprometidos, surgimento de novas cepas mais resistentes e com menor toxicidade dos antifúngicos existentes.
Neste trabalho, a espécie encontrada foi a Candida albicans (100%); os testes de sensibilidade mostraram que todas as amostras foram sensíveis à anfotericina B (100%). Além disso, observou-se 83,30% de resistência para o antifúngico fluconazol; para o antifúngico itraconazol apresentou 66,70% de resistência ao teste de sensibilidade.
Devido ao grande potencial de progressão rápida para a sepse, a administração de antibióticos e antifúngicos de amplo espectro nesses pacientes é essencial. Devem ser considerados os padrões de sensibilidade dos microrganismos para determinar o melhor esquema a ser utilizado,(15) apesar do uso elevado de antibióticos de amplo espectro estar relacionado com o aumento de cepas multirresistentes. Silva, Queiróz e Silva (2021)(16) trazem o manejo odontológico como uma medida profilática a fim de evitar ou diminuir o risco de infecções por microrganismos oportunistas colonizadores da mucosa oral.
Dessa forma, os pacientes oncológicos devem ser orientados quanto à higiene oral, à ingestão de dieta com baixo índice cariogênico, além da limpeza dental, remoção de próteses e aparelhos ortodônticos e dentes comprometidos, como também sobre bochecho com solução de clorexidina 0,12%.
CONCLUSÃO
A mucosite é um efeito colateral muito comum dos fármacos antineoplásicos, pois é formada por células de rápida renovação e com alto metabolismo. A ação dos antineoplásicos ocasiona danos a estas células, tornando a mucosa oral instável, gerando inflamação, vasodilatação, podendo evoluir para lesões e ulcerações. A perda da integridade da mucosa pode ocasionar a invasão do organismo por microrganismos colonizadores da cavidade oral, que normalmente não seriam patogênicos. Além disso, infecções oportunistas em pacientes oncológicos podem evoluir rapidamente se não tratadas, podendo até mesmo ocasionar óbito por sepse.
Os pacientes oncológicos devem ser orientados quanto à higiene da cavidade oral, ao cuidado geral com próteses, dentes comprometidos e aparelhos ortodônticos, de forma que não haja locais propícios para o desenvolvimento dos microrganismos. Além disso, pode ser utilizado enxaguante à base de clorexidina, que é um antimicrobiano tópico, muito usado como agente antisséptico na pele e em mucosas. Salienta-se que o atendimento por uma equipe multiprofissional é de suma importância para que todos os aspectos da saúde física e emocional sejam tratados, para a completa recuperação do paciente, ou para tornar os cuidados paliativos mais humanizados.
As bactérias e fungos identificados nas amostras podem ser classificados como potenciais agentes patogênicos que possuem capacidade para desenvolver quadros infecciosos em pacientes com mucosite oral. Os isolados apresentaram resistência significativa a alguns fármacos, e por isso merecem atenção por parte da equipe de cuidados.
Os eventos adversos relatados se mostraram presentes em pacientes com o sistema imunológico debilitado pelo emprego da quimioterapia como tratamento de doenças onco-hematológicas. Foram observados casos de diarreia, vômitos, febre, neutropenia febril, leucopenia, neutropenia, mucosite e sepse. Ter conhecimento sobre essas adversidades, os fármacos utilizados e seu modo de administração facilita o trabalho dos profissionais da área da saúde em estabelecer um planejamento com o objetivo de diminuir tais manifestações relatadas pelos pacientes.
REFERÊNCIAS
- Oliveira MD et al. Avaliação do perfil epidemiológico das neoplasias onco-hematológicas de pacientes atendidos pelo Instituto de Câncer de Três Lagoas, no período de 2014 a 2018. Brazilian Journal of Development, v. 6, n. 2, p. 7301-7314, 2020.
- Toledo EHR, Diogo MJD. Idosos com afecção onco-hematológica: ações e as dificuldades para o autocuidado no início da doença. Revista Latino-Americana de Enfermagem, v. 11, n. 6, p. 707-712, dez. 2003.
- Jiang M, Bennani NN, Feldman A. Lymphoma classification update: t-cell lymphomas, hodgkin lymphomas, and histiocytic/dendritic cell neoplasms. Expert Review of Hematology, v. 10, n. 3, p. 239-249, 29 jan. 2017.
- Juliusson G, Hough R. Leukemia. Progress in Tumor Research, v. 43, p. 87-100, 2016.
- INCA. Leucemia. Disponível em: <https://www.inca.gov.br/tipos-de-cancer/leucemia/>. Acesso em: janeiro de 2022.
- Brigle K, Rogers B. Pathobiology and Diagnosis of Multiple Myeloma. Seminars In Oncology Nursing, v. 33, n. 3, p. 225-236, 2017.
- Ferreira RG; Franco LFR. Efeitos colaterais decorrentes do tratamento quimioterápico no câncer de mama: revisão bibliográfica. Revista da Universidade Vale do Rio Verde, v. 15, n. 2, 2017.
- Gozzo TO. Toxicidade ao tratamento quimioterápico em mulheres com câncer de mama. 2008. 122 f. Tese (Doutorado) – Curso de Doutor em Enfermagem, Universidade de São Paulo, Ribeirão Preto, 2008.
- Andrade MD, Silva SRD. Administração de quimioterápicos: uma proposta de protocolo de enfermagem. Revista Brasileira de Enfermagem. Brasília, v.60, n.3, 2007.
- Thomsen M, Vitteta L. Adjunctive Treatments for the Prevention of Chemotherapy – and Radiotherapy – Induced Mucositis. Integrative Cancer Therapies, v. 17, n. 4, p. 1027-1047, 2018.
- Volpato LER, et al . Mucosite bucal rádio e quimioinduzida. Rev. Bras. Otorrinolaringol., São Paulo , v. 73, n. 4, p. 562-568, 2007.
- Rabagliati R, et al. Epidemiology of febrile neutropenia in adult patients with acute leukemia and lymphoma: Cohort study of public and private hospital of Santiago, Chile. Rev. Chil. Infectol. v.31, n.6, pp.721-728, 2014.
- Nascimento TG, et al. Neutropenia: ocorrência e manejo em mulheres com câncer de mama em quimioterapia. Rev. Latino-Am Enfermagem. V.4, no.22, pp.301-8, 2014.
- Carvalho PAG, Pereira Júnior AJA, Negreiros WA. Avaliação da dor causada pela mucosite oral em pacientes oncológicos. Rev Dor. v.10, no1, p. 47-50, 2009.
- Barbosa JAA, et al. Utilização de antimicrobianos em pacientes oncológicos hospitalizados. Rev. Bras. Farm., n. 90, p. 69-74, 2009.
- Silva SC, Queiróz CDS, Silva RCD. Principais manifestações bucais em pacientes submetidos a quimioterapia: abordagem e tratamento odontológico. Revista Multidisciplinar do Nordeste Mineiro, Rio Verde, v. 1, n. 1, p. 1-1, 2021.
- Pegado FJN. Infecções orais por Streptococcus sp. e suas repercussões por via sistêmica: relevância clínica em Medicina Dentária. 2010. TCC (Graduação) – Curso de Medicina Dentária, Universidade Fernando Pessoa, Porto, 2010.
- Sobue T, et al. Chemotherapy-induced oral mucositis and associated infections in a novel organotypic model. Molecular Oral Microbiology, v. 33, n. 3, p. 212-223, 2018.
- Mendonça RMH. Associação entre a presença de microrganismos da microbiota oral e a intensidade da mucosite oral, em pacientes pediátricos com Leucemia Linfoide Aguda, submetidos ao tratamento antineoplásico. 2008. 120 f. Tese (Doutorado) – Curso de Doutor em Saúde da Criança e do Adolescente, Unicamp, Campinas, 2008.
- Osakabe L, et al. Influence of Oral Anaerobic Bacteria on Hematopoietic Stem Cell Transplantation Patients: oral mucositis and general condition. Transplantation Proceedings, v. 49, n. 9, p. 2176-2182, nov. 2017.
- Andrioni PC. Influência do tratamento quimioterápico sobre o microbioma oral de pacientes com tumor de cabeça e pescoço. 2019. 51 f. Dissertação (Mestrado) – Curso de Pós-Graduação em Biociências e Saúde, Universidade do Oeste de Santa Catarina, Joaçaba, 2019.
- Ames NJ, et al. A Characterization of the Oral Microbiome in Allogeneic Stem Cell Transplant Patients. Plos One, v. 7, n. 10, p. 1-2, 2012.
- Morais DF, Silva GSA. Sulfametoxazol trimetoprim susceptibilidade e resistência bacteriana: uma revisão teórica. Boletim Informativo Geum, v.8, n.3, p.32-40, 2017.
- Bernardo WLC, et al. Staphylococcus aureus ampicillin-resistant from the odontological clinic environment. Revista do Instituto de Medicina Tropical de São Paulo. V.47, n. 1, pp. 19-24, 2005.
- Campos ACB, et al. Resistência antimicrobiana em Enterococcus faecalis e Enterococcus faecium isolados de carcaças de frango. Pesquisa Veterinária Brasileira, Rio de Janeiro, v. 33, n. 5, p. 575-580, 2013.
- Gaetti-Jardim Junior E, et al. Enterococcus spp. em espécimes clínicos de pacientes atendidos em unidades de terapia intensiva. Archives of Health Investigation, v. 3, n. 3, p. 24-32, 2014.
- Furtado GHC et al. Incidence of vancomycin-resistant Enterococcus at a university hospital in Brazil. Revista Saúde Pública, São Paulo, v. 1, n. 39, p. 41-47, 2005.
- Oliveira MD et al. Avaliação do perfil epidemiológico das neoplasias onco-hematológicas de pacientes atendidos pelo Instituto de Câncer de Três Lagoas, no período de 2014 a 2018. Brazilian Journal Of Development, v. 6, n. 2, p. 7301-7314, 2020.
- Silva FM, et al. Prevalência de colonização de Candida spp. em isolados da mucosa oral de pacientes oncológicos submetidos a tratamento. Revista UiLPS, v. 4, n. 4, p. 1-17, 2016.
- Sousa JP, et al. Estudo do potencial antifúngico e do mecanismo de ação do timol contra cepas de Candida parapsilosis resistentes ao fluconazol e à anfotericina B. Revista de Ciências Médicas e Biológicas, v 19, n. 3, p. 489-494, 2020.
Correspondência
Jordana Salvagni
E-mail: [email protected]
